信息摘要:
砹石与您一起了解UDI码在医疗器械中的应用:UiqueDeviceIdetificatio,医疗器械唯一标识码(简称UDI)是医疗器械唯一身…
砹石与您一起了解UDI码在医疗器械中的应用:
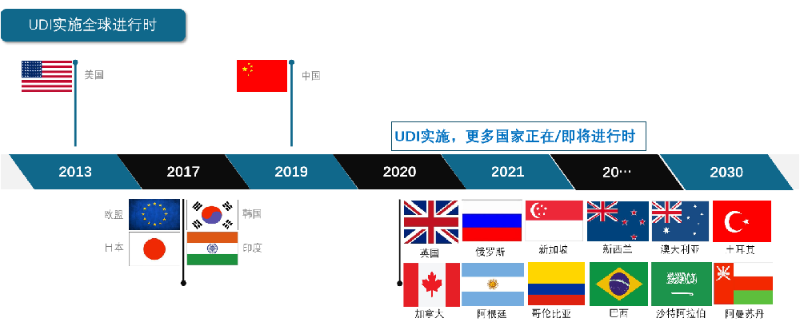
Unique Device Identification,医疗器械唯一标识码(简称UDI)是医疗器械唯一身份识别码。作为国际趋势,美国、欧盟、日本等国家和地区已在积极推进UDI相关工作。早在2013年,美国FDA已发布UDI系统法规并逐步执行,而2017年新颁发的欧盟医疗器械法规MDR(Regulation (EU) 2017/745)自2021年5月26日起适用可植入器械和III类器械,并逐步向I类器械过渡。唯一器械标识码是国际化标准集中管理的必然发展,是全球医疗器械监管手段创新和效能提升的发展方向。全球采用统一的、标准的UDI有利于提高供应链透明度和运作效率;有利于降低运营成本;有利于实现信息共享与交换;有利于不良事件的監控和问题产品召回,提高医疗服务质量,保障患者安全。
2019年7月1日,国家药监局综合司、国家卫生健康委办公厅联合印发《医疗器械唯一标识系统试点工作方案》,方案明确了试点工作的指导思想、基本原则、工作目标、试点范围、职责任务、进度安排以及保障措施,标志着我国医疗器械唯一标识系统试点工作正式启动。首批试点重点品种为心脏、颅脑植入物、假体类高风险值(介)入类医疗器械。
1)2019年7月,确定试点品种、参与单位。成立唯一标识系统试点工作部门协作工作小组,印发试点工作方案。组织开展试点培训,启动试点工作。试点单位制定实施方案,细化任务措施,明确验收指标。
2)2019年8月—11月,组织验证医疗器械唯一标识的创建和赋予。
3)2019年12月—2020年2月,组织验证医疗器械唯一标识数据库的上传、下载和接口标准。
4)2020年3月—6月,组织验证唯一标识数据的部门间衔接和扩展应用。
5)2020年7月,组织召开试点总结会,形成试点报告,完善首批产品唯一标识实施方案。
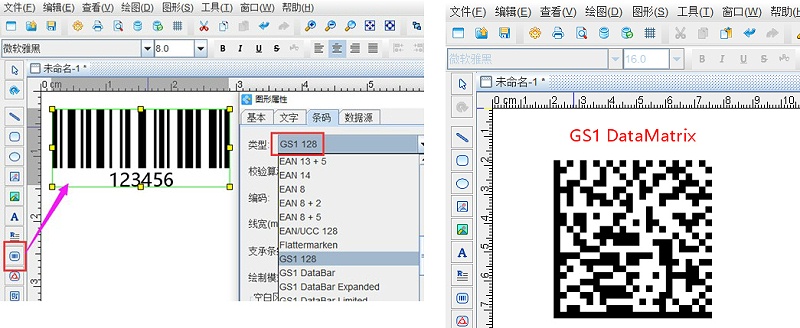
编码UDI时必须符合GS1编码规则,GS1系统已经成为领先者这很大程度上要归功于其全球影响力和采用重叠的市场。
标准封面格式、维度和打印质量对条码符号携带UDI数据,以及用于唯一地标识的编号系统设备和相关的数据字段的数据格式。 最常见的一种GS1-related UPC条形码。 这是用来确定零售产品在整个世界。 它已经被使用在许多医疗设备销售在零售环境中。另外两个常用GS1条形码在UDI GS1 - 128线性条形码和GS1 datamatrix二维码条码。
UDI码的生成的流程大致分为: 1、向签发机构申请产品编码(DI)
2、编制UDI编码
3、把UDI编码生成一维码或者二维码(UDI可以采用GS1 28条码,或者GS1 dataMatrix二维码形式表示)
4、把生成的UDI码印刷在医疗器械上
UDI全球实施时间轴示意图:
关于UDI的实施,FDA和欧盟的异同 相同之处:
1)都是基于并符合国际医疗器械监管机构论坛提出的《UDI应用指南》的要求;
2)三家被认可的发码机构:GS1、HIBCC、ICCBBA;
3)不包括物流;
4)不指定UDI的PI部分;
5)在零售/POS情况下,不需要PI部分;
6)可重复使用的设备需要直接标记UDI;
7)可植入物在被植入前,应进行UDI识别;
8)UDI数据库包含每个器械的核心数据;
9)新产品在投放到市场前,必须将UDI-DI部分输入数据库;其他原因的变化应在30天内完成更改;
10)当设备或者UDI数据库字段发生变化的时候,需要新的UDI-DI;
11)条形码验证。
不同之处:
1)赋UDI的职责:在欧盟是制造商的职责;在美国是贴标签商;
2)器械的分类是不一样的;
3)一次性使用的设备包装除外:在欧盟仅限于I类、IIa、IIb类,而在FDA不受限;
4)在FDA日期的标准格式(YYYY-MM-DD),欧盟没有定义日期格式;
5)关于I类器械:在欧盟DI和PI部分都需在产品上,而在美国只需要有DI部分;
6)标记的采用:在欧盟必须同时采用AIDC和HRI的两种方式。
砹石科技是标签标识的专业厂家,如果您有UDI标识相关需求欢迎致电全国服务热线:4008-822-356咨询!我们有专业的团队为您提供关于UDI标签标识的专业服务。
 长按添加微信咨询
长按添加微信咨询